Presque toutes les réactions chimiques qui ont lieu dans
les systèmes biologiques sont catalysées par des enzymes qui
constituent la classe de protéines à la fois la plus vaste et la plus
spécialisée. Ils représentent l'instrument primaire direct de
l'expression de l'action du gène puisqu'ils catalysent des milliers de
réactions chimiques qui constituent le métabolisme Intermédiaire des
cellules. Chaque réaction est catalysé
par des enzymes spécifique comme les protéases qui permettent
l’hydrolyse les protéines, les protéases a serine les mieux caractérisée
sont la chymotrypsine la trypsine et l’élastase.
Définition :
La
chymotrypsine est une peptidase du groupe des hydrolases, présente dans
le suc pancréatique (liquide sécrété par le pancréas dans l’intestin). .
It belongs to the family of enzymes called serine proteases that
includes trypsin.Il appartient à la famille d'enzymes appelées protéases
à sérine qui comprend la trypsine
la chymotrypsine est composée de 241 acides aminés. Cette enzyme
présente une grande spécificité d’action : elle rompt les liaisons
peptidiques au niveau de certains acides aminés dits hydrophobes comme
la phénylalanine, la tyrosine, le tryptophane.
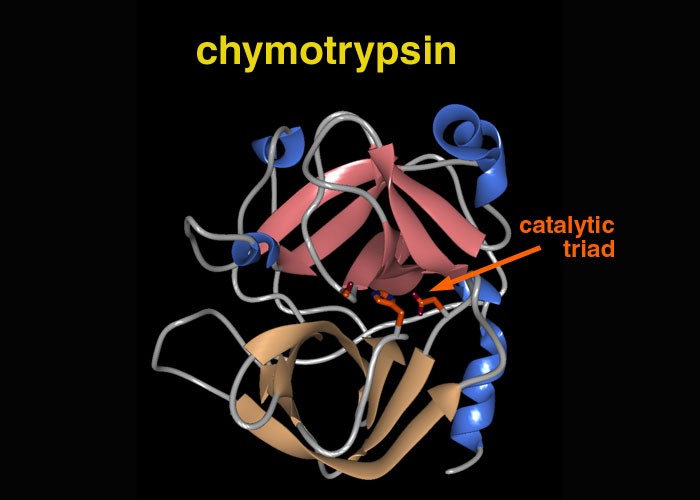
La structure de la chymotrypsine :
La chymotrypsine (protéase à sérine) est constituée de trois segments reliés par des ponts disulfures.
Lorsqu'elle se replie, la chymotrypsine adopte une conformation qui correspond à deux domaines structuraux :
1. Le domaine N-terminal porte deux des trois acides aminés catalytiques : l'histidine 57 (H57) et l'aspartate 102 (D102).
2. Le domaine C-terminal porte la sérine 195 (S195).
Ces 3 acides aminés forment ce que l'on appelle la "triade catalytique" des protéases à sérine.
1 Comparaison entre la [b]Chymotrypsine, trypsine et élastase: une famille de protéines homologues :
L'étude
pratique a mis en évidence la spécificité des protéases chymotrypsine,
trypsine et élastase. L'étude des structures tridimensionnelles a permis
d'établir les relations qui existent entre structure et fonction pour
chaque enzyme. Ainsi, il est établi que les 3 protéases ont une
structure 3D globale très proche et utilisent le même mécanisme
catalytique avec à la base l'intervention de la même triade de résidus
acide aminés, leur spécificité étant liée à la présence dans le site
actif d'une poche dont la conformation diffère pour chacune d'entre
elles.
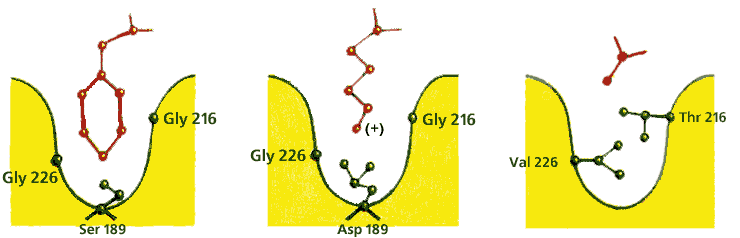
2 Spécificité :
These three proteases are the result of divergent evolution.Ces
trois protéases sont le résultat d'une évolution divergente. They
differ in their specificity: chymotrypsin has a large pocket which
accommodates the large hydrophobic side chains of Phenylalanine,
Tyrosine and Tryptophan, and so catalyses the cleavage of peptides and
esters of these amino acids. Elles diffèrent par leur spécificité: la
chymotrypsine a une grande poche qui accueille les grandes chaînes
latérales hydrophobes de la phénylalanine, la tyrosine et le
tryptophane, et catalyse ainsi le clivage de peptides et des esters de
ces acides aminés. Trypsin has an Aspartate residue (189) at the bottom
of the pocket (instead of Ser-189 as in chymotrypsin), and this Asp
forms a salt bridge with the positively charged group at the end of the
substrate Lysine and Arginine side chains, on which this enzyme acts. La
trypsine a un résidu aspartate (189) au fond de la poche (au lieu de
Ser-189 que dans la chymotrypsine), et ce Asp forme un pont de sel avec
le groupe chargé positivement à la fin du substrat et des chaînes
latérales de lysine arginine, sur que cette enzyme agit. Elastase only
accommodates small hydrophobic side chains eg Alanine, as the mouth of
the pocket is partially blocked by the side chains of Val-216 and
Thr-226 (these residues are both Gly in chymotrypsin). Elastase
n'accueille plus que les petites chaînes latérales hydrophobes, par
exemple l'alanine, l'embouchure de la poche est partiellement obstruée
par les chaînes latérales du Val-216 et Thr-226 (ces résidus sont à la
fois dans la chymotrypsine Gly).
Rôle de la chymotrypsine :
Les
enzymes monomériques dotées d'un seul site actif et fonctionnant en
milieu aqueux sont plutôt l'exception que la règle. En ce qui concerne
le dernier point, certaines enzymes travaillent en milieu non aqueux, comme
dans les membranes limitant la cellule et celles des organites, sans
parler des enzymes capables de métaboliser les hydrocarbures. Cependant
ces enzymes fonctionnent plutôt au sein d'émulsions lipide-eau. Le site
actif des enzymes ancrées dans les membranes (la membrane cellulaire,
lieu d'échange entre les compartiments intra- et extra-cellulaires, est
le siège de multiples activités enzymatiques, comme la circulation de
nutriments, le maintien de la différence de potentiel membranaire, et
régulatrices comme les récepteurs). Il fonctionne dans une poche ou un
canal hydrophile, ou bien encore à l'interface entre la double couche
lipidique et le milieu aqueux qui l'entoure. La notion d'enzyme
membranaire traduit le fait que ces enzymes sont intégrées dans la
membrane par leur partie hydrophobe, tel que la
chymotrypsine, enzyme non membranaire, se localise au cœur de la
micelle inverse et qu'elle ne modifie pas le potentiel d'interaction
intermicellaire. Afin de transformer la chymotrypsine en une enzyme
membranaire, nous avons fixé chimiquement des molécules hydrophobes sur
sa surface. La chymotrypsine ainsi modifiée est en contact avec la
surface de la micelle inverse hôte. Mais contrairement aux protéines
périphériques membranaires qui interagissent électrostatiquement avec
les molécules tensioactives, le potentiel d'interaction intermicellaire
n'est pas modifié.
Classification et dénomination :
Le
nombre d'enzymes varie selon les organismes et la taille de leur génome
fonctionnel (ADN codant) ainsi que selon l'état de la différenciation
des cellules ou de l'organe considérés. Il doit exister chez l'homme
environ 15 000 protéines à activité enzymatique. Certaines enzymes sont
présentes dans toutes les cellules : celles qui réalisent les fonctions
de base du métabolisme cellulaire. D'autres sont regroupées en ensembles
caractéristiques d'un type de tissu ou de cellule donné : elles
correspondent à des états de différenciation cellulaire. Cette
multiplicité à double corps – le nombre de réactions envisageables et le
nombre d'espèces vivantes – pose des problèmes importants de
terminologie. On a
longtemps donné à chaque enzyme un nom en quelque sorte « privé »,
comme hexokinase, aldolase, phosphorylase B, transcriptase inverse du
virus AMV, etc., selon la proposition faite par Émile Duclaux en 1898
d'ajouter le suffixe ase au nom du substrat. Bien que des enzymes soient
parfois connues sous plusieurs noms différents, cette nomenclature est
toujours en usage courant dans les laboratoires et sa connaissance est
essentielle à la communication vernaculaire parmi les chercheurs. Elle
est formellement remplacée par une classification Selon
la structure, leur nom dérive de l'acide aminé ou du métal situé au
niveau de leur site catalytique. C'est ainsi que nous distinguons:
1 Les sérine-protéinases
Les protéases à sérine qui possèdent une triade catalytique caractéristique comprenant une sérine (d'où leur nom), une histidine et un aspartate. Le groupement hydroxyle de la sérine joue le rôle de nucléophile et attaque le carbonyle de la liaison peptidique. Parmi les protéases à sérine, on peut citer :
la trypsine du pancréas (EC 3.2.21.4), spécifique des liaisons peptidiques dans lesquelles l’acide aminé engagé par son carboxyle est une lysine ou une arginine.
la chymotrypsine (EC 3.4.21.1) du pancréas s’attaque à des liaisons peptidiques où le carboxyle engagé est un acide aminé hydrophobe ou aromatique.
la thrombine qui clive le fibrinogène en fibrine lors de la coagulation sanguine. [9]
Il y a aussi d’autre protéases à sérine comme :
les thiol-protéinases
la papaïne (3.4.22.2) protéine végétale
les métallo-protéinases
collagénase (3.4.24;3)
2 Classification de la chymotrypsine :
Les enzymes peuvent être classés selon la réaction qu'elles catalysent avec la nomenclature E.C (Enzyme commission number).
Cette nomenclature est constituée de 4 chiffres EC X1.X2.X3.X4
Le premier chiffre correspond au type de réaction catalysé : classe
Le second correspond au substrat général impliqué lors de la réaction
Le troisième correspond au substrat spécifique impliqué
Le quatrième le numéro de série de l'enzyme.
Il y a 6 classes d'enzymes :
EC1 : Oxydoréductases
EC2 : Transférases: transfèrent un groupement fonctionnel (par exemple un groupe méthyle ou phosphate)
EC3 : Hydrolases
EC4 : Lyases
EC5 : Isomérases:catalysentlesréactionsd’isomérisationdansunesimplemolécule
EC6 : Ligases: joignent deux molécules par des liaisons covalentes
La chymotrypsine : (EC 3.4.21.1)
La chymotrypsine est une protéase il fait partir de la famille de les hydrolases. Le code (EC 3.4.21.1) signifié :
EC 3 :L'hydrolyse est la décomposition d'une molécule par l'action de l'eau. L'eau est réactive grâce à sa décomposition Het OH-(catalysent l'hydrolyse de diverses liaisons).
EC 3.4. : agissant sur les liaisons peptidiques (peptide hydrolases).
EC 3.4.21. : Sérine endopeptidases.
EC 3.4.21.1 : Chymotrypsine
Synthèse et activation :
Les
trois protéases ont une configuration spatiale globale voisine. Elles
présentent cependant chacune, dans leur site actif, une poche avec des
propriétés structurales et fonctionnelles spécifiques. Ainsi, la poche
de la chymotrypsine, profonde, essentiellement hydrophobe, accueille la
chaîne latérale volumineuse de résidus d'acide aminés (appartenant à un
substrat) comme Phe, Trp, Tyr, Met. La poche de la trypsine, également
profonde et en partie hydrophobe accueille la longue chaîne latérale
chargée ( ), des résidus comme Arg ou Lys, à cause de la présence d'un résidu Asp chargé(-)
au fond de la cavité. La poche de l'élastase est réduite à cause du
remplacement de deux résidus Glu par deux autres plus volumineux, elle
ne peut accueillir la chaîne latérale très peu volumineuse de résidus
comme Ala, Gly et quelques autres. Une fois le résidu acide aminé du
substrat stabilisé dans la poche, la catalyse de la réaction d'hydrolyse
se déroule suivant le même mécanisme dans les trois cas avec
intervention de la triade catalytique Ser-His-Asp. Fonctionnellement,
ces trois protéases se complètent.
La chymotrypsine est produite par le pancréas sous une forme inactive : le chymotrypsinogène. L'activation est provoquée par la trypsine qui coupe cette molécule en deux chaînes, puis par la chymotrypsine elle-même lors d'une trans-protéolyse,
donnant à la fin une structure globualire compacte de trois chaînes
reliées par deux ponts disulfures et repliées en 2 domaines de 120
acides aminés.
Régulation de l’activité :
La
régulation de l’activité de l’enzyme se fait par activation
protéolytique. Ces enzyme sont synthétisées sous forme de précurseur non
actif (zymogène) et sont ensuite activées par un clivage protéolytique.
Le manque de régulation provoque une autolyse ou une digestion
prématurée des tissus qui ont synthétisé des protéinases pancréatite
aiguё.

La
trypsine est activée par une entéropeptidase et par auto activation
subséquente- voir la figure précédant. La trypsine peut ensuite activer
d’autres zymogènes, comme la chymotrypsine en la clivant entre les
acides amines 15 et 16. La chymotrypsine s’autolyse ensuite pour exciser
deux dipeptides : Ser14-Arg15 et TH147-ASn148.
[face=Times
New Roman]L’activation se fait lorsque l’extrémité N-terminale Ile16
nouvellement formée migre ver l’intérieur de la molécule et forme une
paire ionique avec Asp194. Ceci a pour conséquence de reformer le site
actif de manière productive notamment la poche qui contrôle la
spécificité de liaison et le « trou pour l’oxyanion » et ainsi permettre
de fixer le substrat adéquatement.[/face][/font">[/font">
[face=Times New Roman]Les
zymogènes ont des sites actifs déformés. Des comparaisons poussées
entre zymogènes et enzymes correspondantes ont permis de comprendre la
faible activité des zymogènes. Même si leurs triades catalytiques se
ressemblent fortement, les poches de spécificité et leurs trous de
l’oxyanion ne sont pas formés correctement.ew Roman']Par
exemple, les résidus de la séquence précédente, suivante et incluant
Ser189, qui forment une partie du mur de la poche de spécificité de la
chymotrypsine, sont organisés de façon spatiale différente empêchant la
liaison du substrat de façon efficace. De plus, le NH amide de Gly193
pointes dans mauvaise direction pour former une liaison hydrogène avec
l’intermédiaire tétraédrique. Ainsi, la très faible activité enzymatique
des zymogénes vient de leur capacité restreinte a se lier au substrat
et de stabiliser l’intermédiaire tétraédrique.[/font">[/face]
[font='Times New Roman'][font='Times New Roman'][font='Times New Roman']br / br /br /font face=][face=Times New Roman][face=Times New Roman]
br /[b">[b">Mécanismes enzymatiques
[b]Les protéases à sérine-chymotrypsine
Plusieurs
enzymes protéolytiques sont appelées protéases à sérine car le
mécanisme de catalyse fait appel à une sérine qui est particulièrement
réactive. la chymotrypsine catalyse l’hydrolyse du lien
peptidique d’une protéine, coupant sur le coté C-terminal des acides
aminiés à longues chaines latérales aromatiques ou hydrophobes.
br /[b]1 Cinétique et groupements catalytiques :
v Utilisation d'un substrat artificiel (p-nitrophénylacétate)
La cinétique enzymatique de la chymotrypsine, révèle deux phases d’activité :
Première phase rapide
Deuxième phase plus lente et constant.

br /[b]2 Résidus de la triade catalytique du site actif de la chymotrypsine
La
sérine 195 de la trypsine (et la sérine équivalente dans les autres
protéases) réagit avec le diisopropyl -fluorophosphate, ce qui indique
sa grande réactivité. En fait la sérine 195 cède très facilement son
proton à His57 et devient alors un nucléophile puissant.
Asp102 maintient l’orientation du groupement imidazole de His57, ce qui favorise l’interaction de ce dernier avec Ser195.
His57
forme une liaison covalente avec le marqueur d’affinité (analogue de
substrat pouvant réagir chimiquement avec des résidus dans le site
actif) TPCK (tosyl-phénylalanine chlorométhylcétone), ce qui indique sa
proximité avec le substrat.
3 Le rôle de triade catalytique
Former des liaisons hydrogène à faible barrière énergétique - "Réseau de relais de charge"
4 Mécanisme catalytique :
Etape 1. Liaison du substrat au site catalytique
La
serine se déprotone (grâce à la triade) et fait une attaque nucléophile
sur l'atome de carbone du carbonyle. Il y a la formation d'un
intermédiaire acyl-enzyme négatif et tétraédrique. La charge négative
est stabilisée par une poche appelé "trou oxyanion" L'intermédiaire
tétraédrique est mieux stabilisé que la molécule plane. L'état de
transition est favorisé. (Déformation du substrat au profit de l'état
intermédiaire.
5 Attaque nucléophile :
L'attaque
nucléophile consiste en l'attaque d'un anion ou d'une molécule
présentant un doublet libre sur un atome de carbone appauvri en
électrons. Le doublet libre du réactif nucléophile cherche à engager une
liaison dative avec l'atome de carbone attaqué.
Un
départ nucléofuge est un départ au cours duquel le doublet de la
liaison rompue s'arrache à l'atome de carbone et part avec l'ancien
substituant.
Le premier cas : l’attaque nucléophile par une molécule
La
fixation par liaison dative du réactif nucléophile sur l'atome de
carbone du groupement carbonyle exige la rupture de la composante π de
la liaison double.
Le deuxième cas : Attaque nucléophile par un atome
La
fixation par liaison dative du réactif nucléophile sur l'atome de
carbone attaqué exige le départ nucléofuge du substituant initial. Un
départ nucléofuge est un départ au cours duquel le doublet de la liaison
rompue s'arrache à l'atome de carbone et part avec l'ancien
substituant.
Stabilisation de l’état de transition dans les sérines protéases
Le trou oxyanion
Le
l'oxygène du groupe acyl forme 2 liaisons hydrogène avec les azote des
chaines principales de la serine 195 et de la Glycine 193. et une
liaison très forte avec une molécule d'eau.
Ce système s'appelle le
trou oxyanion et permet de stabiliser les charges négatives développées
au cours de la réaction (2 états tétraédrique).
De plus il déstabilise l'intermédiaire acylenzyme.
Etape 2 : L’intermédiaire tétraédrique (état de transition)
La
liaison se coupe, La charge développée sur l'azote est compensé par la
captation du proton qui était initialement sur l'histidine.
Etape 3 :
La partie C-terminal de la protéine clivée part Une molécule d'eau arrive.
Mécanisme à deux temps :
Un des deux peptides formés (le peptide carboxy-terminal) quitte le site catalytique et est remplacé par une molécule d’eau
His57 prélève un proton de la molécule d’eau, qui devient un bon attaquant nucléophile.
Etape 4 : Seconde attaque nucléophile, par de l’eau
La molécule d'eau est activée. Elle est déprotonée par l'histidne très basique (asp)
La molécule d'eau attaque l'acyl-enzyme.
L'état intermédiaire tétraédrique et sa charge négative sont à nouveau stabilisé par l'enzyme.
Etape 5
Rupture de la liaison acyl-enzyme et libération du second peptide (amino-terminal)
L'ancienne partie N-term de la protéine clivée se décroche.
L'enzyme est régénéré
L’inhibition de l’activité enzymatique :
Toute
molécule qui modifie la vitesse d'une réaction enzymatique est appelée
un effecteur. Les effecteurs qui augmentent l'activité enzymatique sont
des activateurs. A l'inverse, ceux qui la diminuent sont des
inhibiteurs.
L'inhibition (et l'activation) de l'activité
enzymatique est un mode de régulation primordial des voies métaboliques
dans la cellule, d'autant que les inhibiteurs naturels peuvent prendre
de multiples formes : antibiotiques, toxines, drogues, poisons ... Le
développement d’inhibiteurs est un volet important de la synthèse
organique qui se pratique de façon efficace lorsque jumelée à une
excellente compréhension du mécanisme d’inhibition, au niveau
moléculaire.
1 Les agents modulateurs de l’activité enzymatique
L'étude de l'effet d'inhibiteurs permet :
Certains
inhibiteurs s'associent de manière réversible à l'enzyme en
interagissant de manière non covalente. D'autres se fixent de manière
irréversible et sont souvent utilisés pour déterminer les groupes actifs
du site catalytique.
1.1 Inhibitions irréversibles :
L’inhibition
irréversible d’un enzyme aurait un intérêt modeste, voire nul, dans le
cadre du contrôle physiologique du métabolisme, dont les réactions
doivent plutôt être ajustées en permanence que définitivement bloquées
tant que de nouvelles molécules d’enzymes ne sont pas synthétisées. En
revanche, et cela permet de noter que les enzymes sont la cible de
nombreux médicaments, une inhibition enzymatique irréversible peut avoir
un intérêt thérapeutique.
Soit un médicament parmi les plus anciens,
les plus connus et les plus utilisés, l’aspirine. Il fait partie d’une
classe de médicaments appelés Anti-Inflammatoires Non Stéroïdiens
(AINS). Les AINS inhibent des enzymes, les cyclo-oxygénases (COX), qui
concourent à la production des prostaglandines, de la prostacycline et
du thromboxane à partir de l’acide arachidonique (voir la figure page
suivante). On les appelle d’ailleurs aussi prostaglandine synthases.
Les
COX forment une sorte de canal dans lequel le substrat, l’acide
arachidonique, entre pour être transformé. La plupart des AINS sont des
inhibiteurs réversibles des COX. En revanche, en acétylant, c’est-à-dire
en formant une liaison covalente (liaison ester) avec la fonction
hydroxyle d’une sérine de la protéine enzymatique, sérine qui est à
proximité du site catalytique, mais non en son sein, l’aspirine provoque
de manière irréversible pour chaque molécule d’enzyme ainsi modifiée un
encombrement dans la lumière du canal qui empêche le substrat d’y
entrer et donc d’être transformé. L'activité enzymatique est donc
bloquée irréversiblement, jusqu'à ce que l'organisme ait de nouveau
synthétisé l'enzyme (Figure N°16).La capacité limitée des plaquettes
(anucléées) à régénérer des protéines en fait une cible particulière de
l’aspirine. L’administration chronique de faibles doses d’aspirine
provoque une réduction de la production du principal produit de l’action
des COX plaquettaires, le thromboxane, qui est vasoconstricteur et
favorise l’agrégation plaquettaire et la thrombose. L’aspirine à faible
dose est ainsi un traitement préventif secondaire efficace de
l’infarctus du myocarde et de l’ischémie cérébrale.
1.2 Inhibitions réversibles :
Les
inhibiteurs réversibles des enzymes sont des molécules qui vont
interférer avec une étape de la catalyse. Ils sont très utiles pour la
compréhension des mécanismes enzymatiques ; ils peuvent être aussi, nous
venons de le signaler pour les AINS (sauf l’aspirine), des médicaments
importants. Les inhibiteurs réversibles se fixent sur l'enzyme à l'aide
de liaisons faibles comme celles engagées entre l'enzyme et le substrat.
Celles-ci se forment rapidement et peuvent être rompues facilement.
Il
existe trois types d’inhibition enzymatique réversible selon le
mécanisme d’action de la molécule inhibitrice : inhibition compétitive,
incompétitive et non compétitive.
Enfin, selon le type d'inhibiteur, l'enzyme peut fixer :
Le substrat OU l'inhibiteur
Le substrat ET l'inhibiteur
Puisque
la chymotrypsine possédé un seul site de fixation ; où la fixation de
l'inhibiteur empêche celle du substrat ; on parle alors d’une inhibition
compétitive.
2 Qu’est ce que une Inhibition compétitive ou fixation exclusive ?
Dans
tous les cas, l'inhibition compétitive est un mécanisme où la fixation
de l'inhibiteur empêche celle du substrat (et réciproquement) : la
fixation du substrat et celle de l'inhibiteur sont donc mutuellement
exclusives.
2.1 Le mécanisme réactionnel :
Différents modèles rendent compte du mécanisme de l'inhibition compétitive :
Dans
le modèle 1 il n'existe qu'UN site de fixation pour les deux molécules :
la fixation mutuellement exclusive résulte d'une ANALOGIE de STRUCTURE
entre le substrat et l'inhibiteur.
Il existe cependant d'autres
modèles (dont le modèle2) où le substrat et l'inhibiteur se fixent sur
des sites distincts. L'inhibition est malgré tout de type compétitif
pour diverses raisons structurales.
En présence de ce type d'inhibiteur :
KM est augmentée mais VM n'est pas modifiée (voir tableau ci-dessous) ;
cela signifie que l'inhibition compétitive peut-être ‘soulagée’ à concentration saturante en substrat.
Exemples d’inhibition compétitive :
La
trypsine bovine, une protéase digestive semblable à la chymotrypsine,
est efficacement inhibée par une protéine, le ‘BPTI’ (inhibiteur de
trypsine pancréatique bovine). Cette protéine se lie, tout comme si elle
était un substrat (avec une Lys qui assure la reconnaissance spécifique
de la trypsine) mais elle forme des contacts si nombreux et serrés avec
toute la région du site actif qu’aucune molécule d’eau ne peut y
parvenir. Sans eau, l’étape de désacylation ne peut s’effectuer. De
plus, il se forme tant de contacts avec le substrat que même si
l’hydrolyse de la liaison peptidique ‘centrale’ du BPTI a lieu, les
produits ne peuvent s’échapper.
Le BPTI est un inhibiteur
compétitif par rapport aux substrats de la trypsine. Le BPTI se lie avec
une constante dissociation (KD) = 10 13M; ainsi, si la trypsine est
exposée à une solution de BPTI de 10-13 M, la trypsine sera à 50% liée
par le BPTI.
1.3 Le DIFP : Inhibitions irréversibles
Le
DIFP inhibe irréversiblement la chymotrypsine. On a pu montrer qu'il se
lie de manière covalente et stable au résidu Ser 195, la réaction
impliquant le groupement hydroxyle de la chaîne latérale de cet acide
aminé. Les 27 autres résidus sérine de la molécule d'enzyme ne
réagissent pas avec cet inhibiteur, ce qui met en évidence la très
grande aptitude à réagir de Ser 195. L'inactivation chimique de l'enzyme
par le DIFP montre que Ser 195 doit participer au mécanisme
catalytique.Le chymotrypsinogène (=chymotrypsine inactive) doit être
hydroxylé plusieurs fois (dont une par la chymotrypsine) pour être
activé. le DIFP se fixe sur une sérine et empêche le fonctionnement de
ta chymotrypsine (car il bloque l'accès,il empêche le contact entre le
site actif et le ligand), et empêche ainsi l'activation du
chymotrypsinogène ...Le mécanisme de cette inhibiteur et de formé une
liaison covalente avec la serine 195* du site active, mais normalement
la liaison formé doit être hydrolysé par l'eau, donc comment le DIFP
empêche l'eau d'hydrolysé la liaison.
Le mécanisme de cet inhibiteur :
Ser195.
La réaction d'une protéase à sérine avec le
diisopropylphosphofluoridate (DIFP) qui inactive l'enzyme de façon
irréversible, est un test pour mettre en evidence la Ser active:

His57. Ce résidu catalytique a été découvert par marquage d'affinité avec un analogue de substrat réactif

Contrôle de l’activité enzymatique :
La
cellule a donc besoin d'un système fiable de régulation pour gérer
toute cette activité bourdonnante. L’activité enzymatique peut
s’exprimer par la quantité de substrat transformée par unité de temps et
par molécule (ou unité de masse) d’enzyme, ou par la quantité d’enzyme
nécessaire pour transformer 1 unité (par exemple 1 molécule) de substrat
par unité de temps, dans des conditions définies. Le fait que la
quasi-totalité des réactions qui surviennent dans l’organisme soient
catalysées par des enzymes permet donc un contrôle très fin de la
vitesse de ces réactions, via des modifications de l’activité des
enzymes.
Ces modifications sont une caractéristique essentielle,
vraiment très importante, des enzymes, qui les distinguent encore des
catalyseurs non organiques. Ainsi, étant donné qu’ils sont des
protéines, les enzymes sont sensibles aux variations du pH ou de la
température qui peuvent affecter considérablement leur activité. C’est à
la régulation de l’activité des enzymes que la suite de ce cours est
consacrée.
1 Rôle du pH
Beaucoup d’enzymes
ont un pH caractéristique pour lequel la vitesse de la réaction
catalysée est maximum, et souvent la vitesse diminue en deçà et au-delà
de cette valeur de pH. Le graphe de la page suivante qui exprime la
vitesse de la réaction (en ordonnée) en fonction du pH (toutes choses
égales par ailleurs) pour trois enzymes distincts en fournit une
illustration. Elle montre que l’activité enzymatique dépend du pH et que
cette dépendance est spécifique à chaque enzyme.
Ces courbes
dépendent de divers facteurs. En particulier, quand le pH change, l’état
d’ionisation des groupements chargés, aussi bien dans le site actif de
l’enzyme (en fonction du pK propre à chaque résidu chargé participant à
la constitution du site actif) que dans le substrat varie, ce qui
affecte la vitesse de formation et de dissociation du complexe enzyme-
substrat. Le pH optimum d’un enzyme n’est pas forcément identique au pH
de son environnement normal, ce qui indique que le pH local peut exercer
une influence régulatrice sur l’activité de l’enzyme. En outre, le pH
optimum pour l’activité enzymatique ne correspond pas nécessairement au
pH auquel la protéine enzymatique est la plus stable, et un effet des
variations de pH peut être de provoquer une dénaturation de la protéine
enzymatique.
2 Rôle de la température
Les effets
de la température sur l’activité d’un enzyme sont complexes et peuvent
être considérés comme le résultat de l’action de deux forces agissant
simultanément mais dans des sens opposés. Quand la température augmente,
la vitesse de la réaction augmente (en raison de l’accroissement de
l’énergie cinétique des molécules), mais en même temps il y a une
inactivation (dénaturation) progressive de la protéine enzymatique.
Cette dénaturation est d’autant plus prononcée que la température
augmente, de telle sorte que, comme on le voit dans la figure
ci-dessous, il existe une température optimale apparente. La
dénaturation thermique est fonction du temps, et, pour un enzyme,
l’expression « température optimale » n’a pas grand sens si la durée de
l’exposition à une température donnée n’est pas indiquée.
La
température à laquelle la dénaturation devient un facteur important
varie d’un enzyme à l’autre. Généralement, la dénaturation est
négligeable en dessous de 30°C et commence à être appréciable au-delà de
40°C. Quelques enzymes gardent une activité importante à des
températures bien supérieures, par exemple les enzymes des bactéries
thermophiles (figure ci- dessous), et cette propriété a des applications
pratiques importantes.
Conclusion :
On
peut dire que les enzymes se sont les points clés ; car ils sont
capables d’interagir spécifiquement avec un type de molécule et ils
peuvent réaliser une stabilisation de l’état de transition .La
configuration spatiale de l’enzyme, sous la dépendance des facteurs du
milieu, détermine son activité. Toute modification de la forme de la
molécule peut conduire à la perte de sa capacité catalytique ou à son
augmentation, ce qui entraîne une plasticité du phénotype voire une
altération. L’activité enzymatique se répercute à tout moment sur les
fonctions de la cellule et contribue ainsi à la réalisation du
phénotype.
SOURCE
[ندعوك للتسجيل في المنتدى أو التعريف بنفسك لمعاينة هذا الرابط]
[/face][/face][/face]






» إختبار الثلاثي الثالث مادة العلوم الطبيعية
» دلیل بناء اختبار مادة علوم الطبیعة والحیاة في امتحان شھادة البكالوریا – أكتوبر 2017
» ملفات مفتوحة المصدر لجميع مصممين الدعاية والاعلان
» مادة الرياضيات السنة الاولى ثانوي
» برنامج لصنع توقيت مؤسسة تربوية
» كل ما يخص الثانية متوسط من مذكرات ووثائق للأساتذة
» المنهاج والوثيقة المرافقة له للجيل الثاني في كل المواد لمرحلة التعليم المتوسط
» دليل استخدام كتاب الرياضيات الجيل الثاني سنة4