La réplication du matériel génétique | ||
| ||
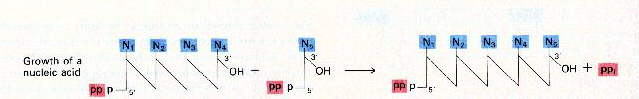 | ||
| Les A.D.N polymérases ne fonctionnent que dans le sens 5' 3'. Des enzymes déroulent Sur un des brins d'A.D.N. la synthèse de la copie se fait de manière continue alors que sur l'autre elle s'effectue de manière discontinue, par fragments qui sont ensuite "collés" par d'autres enzymes (des ligases.) | ||
 | ||
oeil ou fourches de réplication (microscopie électronique) |
 Un modèlede synthèse "semi conservatif" de l'ADNreposant sur cette observation a été proposé et s'estavéré exact.Lorsque l'information est transmise, d'une cellule à deux cellulesfilles, les copies (positif et négatif) doivent êtrereprésentées dans les deux cellules : le modèle proposeque chaque copie conserve un des deux éléments du modèle(d'où l'expression semi conservative associée à cetteduplication), le négatif ancien et un positif nouvellementsynthétisé va être hérité par une cellulefille, le positif ancien et un négatif nouvellement synthétiséétant hérité par l'autre cellule fille.En moins d'un an, Meselson et Stahl concevaient une expériencerestée célèbre pour vérifier ces prédictions.3.1 EXPERIENCE DE MESELSON ET STAHL:Il s'agissait de "marquer" les éléments anciens (négatifet positif) et de les suivre lors de la transmission aux générationssuivantes. Le marqueur choisi a été unisotope lourd de l'azote : l'azote 15 (15N),en raison de l'abondance des atomes d'azote dans les bases organiques del'ADN, si tous sont constitués de l'isotope lourd, la moléculed'ADN résultante sera légèrement plus dense que celled'ADN habituel (comportant de l'azote 14) et il va s'avérer possiblede séparer ces deux types de molécules par une centrifugationà l'équilibre dans un gradient de densité de chlorurede césium (gradient qui "encadre" les densités des ADN àétudier). Le matériel expérimental est une celluleprocaryotique : Escherichia coli. Les bactéries sont en effet lescellules présentant le plus haut rendement synthétique et dansdes conditions standard se divisent environ toutes les trente minutes cequi va permettre d'accéder à plusieurs générationset donc à plusieurs cycles de réplication de l'ADN en un tempsraisonnable.
Un modèlede synthèse "semi conservatif" de l'ADNreposant sur cette observation a été proposé et s'estavéré exact.Lorsque l'information est transmise, d'une cellule à deux cellulesfilles, les copies (positif et négatif) doivent êtrereprésentées dans les deux cellules : le modèle proposeque chaque copie conserve un des deux éléments du modèle(d'où l'expression semi conservative associée à cetteduplication), le négatif ancien et un positif nouvellementsynthétisé va être hérité par une cellulefille, le positif ancien et un négatif nouvellement synthétiséétant hérité par l'autre cellule fille.En moins d'un an, Meselson et Stahl concevaient une expériencerestée célèbre pour vérifier ces prédictions.3.1 EXPERIENCE DE MESELSON ET STAHL:Il s'agissait de "marquer" les éléments anciens (négatifet positif) et de les suivre lors de la transmission aux générationssuivantes. Le marqueur choisi a été unisotope lourd de l'azote : l'azote 15 (15N),en raison de l'abondance des atomes d'azote dans les bases organiques del'ADN, si tous sont constitués de l'isotope lourd, la moléculed'ADN résultante sera légèrement plus dense que celled'ADN habituel (comportant de l'azote 14) et il va s'avérer possiblede séparer ces deux types de molécules par une centrifugationà l'équilibre dans un gradient de densité de chlorurede césium (gradient qui "encadre" les densités des ADN àétudier). Le matériel expérimental est une celluleprocaryotique : Escherichia coli. Les bactéries sont en effet lescellules présentant le plus haut rendement synthétique et dansdes conditions standard se divisent environ toutes les trente minutes cequi va permettre d'accéder à plusieurs générationset donc à plusieurs cycles de réplication de l'ADN en un tempsraisonnable. Le protocoleexpérimental reste un modèle du genre : dans un premier tempsdes bactéries sont cultivées sur un milieu contenant l'isotopelourd de l'azote, après un délai correspondant à plusieurscycles cellulaires, la comparaison des ADN purifiés à partirde ces bactéries et d'ADN provenant de cellules normales "14N" montrequ'il est effectivement possible de les séparer .
Le protocoleexpérimental reste un modèle du genre : dans un premier tempsdes bactéries sont cultivées sur un milieu contenant l'isotopelourd de l'azote, après un délai correspondant à plusieurscycles cellulaires, la comparaison des ADN purifiés à partirde ces bactéries et d'ADN provenant de cellules normales "14N" montrequ'il est effectivement possible de les séparer .Les bactéries dont l'ADN est ainsi marqué sont ensuitecultivées sur un milieu normal de telle sorte qu'à partir decet instant, toute synthèse se fera à partir d'azote 14, desprélèvement sont effectués de générationen génération et les ADN analysés. Les résultatsprésentés dans la figure, montrent qu'effectivement, enpremière génération, un ADN de densité hybrideest caractérisé, la suite de l'expérience montre clairementque l'hypothèse de réplication semi conservative étaitjuste !Très rapidement, plusieurs travaux remarquables confirment le modede réplication de l'ADN et laissent entrevoir la complexitédu contrôle génétique de cette biosynthèse.Dans les années 50 à 60, Kornberg réalise une premièresynthèse d'ADN in vitro et Cairns "visualise" la réplicationen microscopie électronique.3.2 SYNTHESE D'ADN IN VITRO : première manipulationgénétiqueLes séries d'expériences réalisées par Kornberget son groupe préfigurent la génétique moléculairemoderne et méritent que l'on s'y arrête.Le mode semi-conservatif de la synthèse de l'ADN implique leséléments suivants :
- - une molécule d'ADN double brin capable de servir de modèle,
- - des désoxyribonucléotides précurseurs de la chaîne nouvelle,
- - une enzyme : ADN-polymérase, capable de les relier, cette enzyme (hypothétique pour l'instant) est fondamentale car non seulement elle devra assurer la liaison covalente (3'-5' phosphodiester) entre les nucléotides mais elle devra aussi être capable de "choisir" ceux-ci en fonction du modèle présent selon la régle d'appariement des bases.
Comment évaluer de tels systèmes ? Comment prouver qu'unesynthèse a bien lieu in vitro ? Comment distinguer l'ADNnéosynthétisé de celui qui est obligatoirement présentdans l'extrait comme modèle ?
Kornberg va lui aussi faire appel à des marqueurs isotopiques : desnucléotides comportant des phosphores 32 radioactifs (32P), si unesynthèse a lieu, elle fera appel à ces précurseursradioactifs et le polymère résultant sera "marqué",sera radioactif et facilement repérable. D'après l'analysedes nucléotides libres présents dans le cytoplasme, Kornbergdécide de choisir des nucléotides triphosphorylés en5' alors que les constituants de l'ADN sont monophosphorylés et quebien souvent, l'hydrolyse de polynucléotides produit desmononucléotides phosphorylés en 3' ! On verra que sans cettedécision, l'expérience était vouée àl'échec : la cellule utilise effectivement des nucléotides5' triphosphorylés et l'énergie fournie par la libérationdu pyrophosphate.*Remarque concernant l'utilisation de précurseurs radioactifsDans son mélange réactionnel, Kornberg dispose d'ADN modèle,de précurseurs naturels, de l'ADN polymérase active (ill'espère), auquel il ajoute des précurseurs radioactifs.Après la réaction, la radioactivité se trouverapartagée entre l'ADN éventuellement synthétiséin vitro (en incorporant des monomères marqués) et l'excédentde précurseurs qui n'ont pas été incorporés.Il est donc essentiel d'éliminer tous ces précurseurs librespour attribuer de la radioactivité à une macromolécule.En pratique, les macromolécules sont précipitées paradjonction d'un acide organique et les petites molécules "acido-solubles"(y compris les précurseurs radioactifs) sont éliminéespar centrifugation. Le culot, après plusieurs lavages, contient lesmacromolécules (y compris l'ADN) débarrassées de toutprécurseur non incorporé dans la chaîne.En suivant la stratégie exposée et ses contraintes, Kornbergfut capable de trouver quelque radioactivité dans des fractionsacido-précipitables. Radioactivité qui, à l'époquene dépassait guère le seuil de confiance des compteurs, maisKornberg y croyait !
Plusieurs équipes, partant de kilogrammes de pâte d'E.coli,à l'aide de méthodes d'analyse biochimique classiques de nosjours mais que l'on découvrait à l'époque, ont peu àpeu concentré l'activité de l'ADN polymérase jusqu'àpurifier cette enzyme qui fut nommée "polymérase de Kornberg".Le bilan (provisoire) de ces expériences est le suivant :
 3.2.2 REPLICATION IN VITRO L'expérience décrite ci dessus prouve qu'une synthèsede polydésoxyribonucléotide est réalisable in vitromais ne prouve pas que l'ADN synthétisé est conforme aumodèle ni que la synthèse soit une réplicationsemi-conservative.
3.2.2 REPLICATION IN VITRO L'expérience décrite ci dessus prouve qu'une synthèsede polydésoxyribonucléotide est réalisable in vitromais ne prouve pas que l'ADN synthétisé est conforme aumodèle ni que la synthèse soit une réplicationsemi-conservative.La suite du travail va consister à tenter la synthèse in vitrod'un ADN "biologiquement actif", l'activité biologique la plus facileà détecter étant, à l'époque, lacapacité d'infection d'un ADN de bactériophage.Le modèle choisi est le phage ÞX 174 soit une moléculecirculaire d'environ 5000 nucléotides seulement. Nucléotideset non pas paires de nucléotides car il s'agit, pour la particulephagique d'un ADN simple brin que nous appellerons le brin +. Le changementd'un seul de ces nucléotides rend la molécule inactive (noninfectieuse). La réalisation d'une copie infectieuse in vitro vapréfigurer la technologie de l'ADN recombinant.
- - In vivo, la première étape de l'infection par ce bactériophage simple brin est la synthèse d'un brin complémentaire pour réaliser une forme circulaire double brin à partir de laquelle seront reproduits des brins + qui assureront la descendance phagique.
- - Un premier problème se posa pour la synthèse in vitro d'un brin - : l'ADN polymérase purifiée ne peut qu'attacher l'extrémité 5' d'un nucléotide à l'extrémité 3' d'une chaîne en cours de synthèse, elle ne peut relier des polynucléotides et donc ne peut pas réaliser la liaison phosphodiester qui permet de circulariser un brin d'ADN. Le problème a été résolu par la purification d'une enzyme qui, in vivo, remplit cette fonction : l'ADN ligase dont nous aurons souvent l'occasion de parler.
- Le système va donc comprendre :
- des molécules d'ADN purifiées de ÞX 174 (brin +)
- les 4 désoxyribonucléotides
- l'ADN polymérase
- la ligase
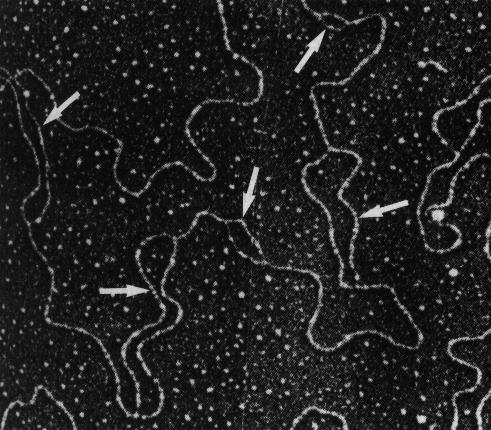
 La préparationest recouverte d'une émulsion photographique et après expositionet développement, l'examen révèle des grains d'argentle long de la molécule d'ADN . Ces premières observations ontmontré la circularité du chromosome d'E.coli, forme quis'avérera très répandue chez les procaryotes, les viruset l'ADN des organites (mitochondries et chloroplastes) des celluleseucaryotiques. Dans un second temps, Cairns a effectué des marquagesplus courts et déduit des images présentée que laréplication commence en un point du chromosome bactérien etfait le tour de celui-ci. Un peu plus tard, d'autres chercheurs ont ajoutéà un marquage long par la thymidine tritiée à faibleactivité spécifique un marquage très bref par de lathymidine tritiée à forte activité spécifique.Après autoradiographie, l'intensité des grains permet de distinguerles deux marquages. On observe alors, des sortes de "bulles".L'interprétation de ces figures va avoir un impact considérable.
La préparationest recouverte d'une émulsion photographique et après expositionet développement, l'examen révèle des grains d'argentle long de la molécule d'ADN . Ces premières observations ontmontré la circularité du chromosome d'E.coli, forme quis'avérera très répandue chez les procaryotes, les viruset l'ADN des organites (mitochondries et chloroplastes) des celluleseucaryotiques. Dans un second temps, Cairns a effectué des marquagesplus courts et déduit des images présentée que laréplication commence en un point du chromosome bactérien etfait le tour de celui-ci. Un peu plus tard, d'autres chercheurs ont ajoutéà un marquage long par la thymidine tritiée à faibleactivité spécifique un marquage très bref par de lathymidine tritiée à forte activité spécifique.Après autoradiographie, l'intensité des grains permet de distinguerles deux marquages. On observe alors, des sortes de "bulles".L'interprétation de ces figures va avoir un impact considérable.- - d'après l'observation de ces "fourches" , il est clair que la réplication se fait à partir des deux brins anciens simultanément (les figures matérialisées par les grains d'argent seront appelées fourches de réplication).
- - puisque l'on observe deux de ces fourches, c'est que la réplication est bidirectionnelle.
- - si la réplication est bidirectionnelle c'est qu'il existe une "origine de réplication". Cette notion n'est pas que topographique, on verra qu'effectivement, seule une séquence précise de ces molécules circulaires permet le démarrage de la réplication. Dans la cellule Eucaryote, les chromosomes comportent des molécules linéaires d'ADN très longues et il existe plusieurs origines de réplication par chromosome, également caractérisées par des séquences précises.
Des mutants pour chacune de ces étapes ont permis de les étudieren détail, c'est l'initiation qui représente certainementl'étape clé de la réplication.
 - Une première difficulté d'interprétation est venuede l'étude du fonctionnement de l'ADN polymérase : elle permetla liaison de nucléotides à l'extrémité 3' d'unechaîne polynucléotidique. Les deux brins anciens, servant demodèles, étant antiparallèles, comment expliquerl'observation d'une synthèse bidirectionnelle, simultanée pourles deux brins avec fourche de réplication ?
- Une première difficulté d'interprétation est venuede l'étude du fonctionnement de l'ADN polymérase : elle permetla liaison de nucléotides à l'extrémité 3' d'unechaîne polynucléotidique. Les deux brins anciens, servant demodèles, étant antiparallèles, comment expliquerl'observation d'une synthèse bidirectionnelle, simultanée pourles deux brins avec fourche de réplication ? Une hypothèsede synthèse continue sur l'un des brins et discontinue sur l'autrea été confirmée par Okasaki qui, par centrifugationsur gradient de densité a pu isoler des intermédiaires desynthèse de l'ADN d'environ 150 paires de bases. Ce modèlede "un pas en avant, deux pas en arrière, un pas en avant etc..."effectués par l'ADN polymérase sur l'un des deux brins, expliquel'observation globale de la fourche de réplication. La figure ci-contrerésume la synthèse continue sur l'un des brins dit parfois"brin avancé" et discontinue sur l'autre dit "brin retardé".la figure ci-dessous met en place quelques protéines égalementessentielles de la réplication.
Une hypothèsede synthèse continue sur l'un des brins et discontinue sur l'autrea été confirmée par Okasaki qui, par centrifugationsur gradient de densité a pu isoler des intermédiaires desynthèse de l'ADN d'environ 150 paires de bases. Ce modèlede "un pas en avant, deux pas en arrière, un pas en avant etc..."effectués par l'ADN polymérase sur l'un des deux brins, expliquel'observation globale de la fourche de réplication. La figure ci-contrerésume la synthèse continue sur l'un des brins dit parfois"brin avancé" et discontinue sur l'autre dit "brin retardé".la figure ci-dessous met en place quelques protéines égalementessentielles de la réplication. - L'étude biochimique des ADN polymérases (car il en existeplusieurs avec chacune un rôle précis dans la cellule), aégalement montré qu'aucune n'était capable de relierdeux mononucléotides entre eux comme peut le faire l'ARN polyméraseque nous verrons au chapitre mais, comme il a été dit, ellecrée une liaison phosphodiester entre le 5' d'un mononucléotideet l'extrémité 3'OH d'une chaîne déjàcommencée. Ces chaînes préexistantes constituent des"amorces" pour les ADN- polymérases etvont être fabriquées, aux origines de réplications pardes "primases" qui sont elles mêmes despolymérases utilisant des ribonucléotides.Ceci implique que chaque "fragment d'Okasaki"(du nom de l'auteur des travaux ayant prouvé que le mode de synthèseest bel et bien discontinu pour l'un des brins) est précédéd'une amorce d'ARN, qui devra être éliminée, remplacéepar une séquence d'ADN et qu'une ligase devra intervenir pour relierles morceaux au cours de l'élongation.Cette analyse, liée en grande partie à l'étude de mutants,a également permis de découvrir que l'enzyme de Kornbergn'était pas la seule ADN polymérase présente dans lacellule bactérienne (par contre elle est la plus abondante). A cotéde cette enzyme, rebaptisée ADN polymérase I, il existe desADN polymérases II et III.
- L'étude biochimique des ADN polymérases (car il en existeplusieurs avec chacune un rôle précis dans la cellule), aégalement montré qu'aucune n'était capable de relierdeux mononucléotides entre eux comme peut le faire l'ARN polyméraseque nous verrons au chapitre mais, comme il a été dit, ellecrée une liaison phosphodiester entre le 5' d'un mononucléotideet l'extrémité 3'OH d'une chaîne déjàcommencée. Ces chaînes préexistantes constituent des"amorces" pour les ADN- polymérases etvont être fabriquées, aux origines de réplications pardes "primases" qui sont elles mêmes despolymérases utilisant des ribonucléotides.Ceci implique que chaque "fragment d'Okasaki"(du nom de l'auteur des travaux ayant prouvé que le mode de synthèseest bel et bien discontinu pour l'un des brins) est précédéd'une amorce d'ARN, qui devra être éliminée, remplacéepar une séquence d'ADN et qu'une ligase devra intervenir pour relierles morceaux au cours de l'élongation.Cette analyse, liée en grande partie à l'étude de mutants,a également permis de découvrir que l'enzyme de Kornbergn'était pas la seule ADN polymérase présente dans lacellule bactérienne (par contre elle est la plus abondante). A cotéde cette enzyme, rebaptisée ADN polymérase I, il existe desADN polymérases II et III.Ces trois enzymes ont des propriétés communes mais n'assurentpas exactement les mêmes fonctions in vivo.
On sait maintenant que la polymérase purifiée par Kornbergn'est pas celle qui assure l'élongation c'est à dire l'essentielde la réplication in vivo mais l'ADN polymérase III.
 Toutes catalysentl'adjonction d'un nucléoside 5' triphosphate àl'extrémité 3' d'un polynucléotide en créantune liaison covalente 3' 5' phosphodiester. Toutes possèdentégalement des activités exonucléasiques, c'est àdire qu'elles sont capable d'exercer une fonction inverse d'hydrolyse deliaison phosphodiester, soit dans le sens 3'-5' soit 5'-3' soit dans lesdeux, cette activité joue un grand rôle dans le contrôlede la fidélité de la réplication en permettant àl'enzyme elle-même de corriger des erreurs d'appariement qu'elle auraitpu commettre (elle joue également un rôle dans la réparationde molécules d'ADN endommagées par divers agents).
Toutes catalysentl'adjonction d'un nucléoside 5' triphosphate àl'extrémité 3' d'un polynucléotide en créantune liaison covalente 3' 5' phosphodiester. Toutes possèdentégalement des activités exonucléasiques, c'est àdire qu'elles sont capable d'exercer une fonction inverse d'hydrolyse deliaison phosphodiester, soit dans le sens 3'-5' soit 5'-3' soit dans lesdeux, cette activité joue un grand rôle dans le contrôlede la fidélité de la réplication en permettant àl'enzyme elle-même de corriger des erreurs d'appariement qu'elle auraitpu commettre (elle joue également un rôle dans la réparationde molécules d'ADN endommagées par divers agents).Grâce à cette "double compétence", la polyméraseI est capable de dégrader les amorces d'ARN tout en "bouchant lestrous", la ligase intervenant en dernier.C'est probablement au prix de la complication des mécanismes enzymatiquesévoqués que la fidélité de la réplicationest assurée et que l'information génétique se transmetintacte de générations en générations.







» إختبار الثلاثي الثالث مادة العلوم الطبيعية
» دلیل بناء اختبار مادة علوم الطبیعة والحیاة في امتحان شھادة البكالوریا – أكتوبر 2017
» ملفات مفتوحة المصدر لجميع مصممين الدعاية والاعلان
» مادة الرياضيات السنة الاولى ثانوي
» برنامج لصنع توقيت مؤسسة تربوية
» كل ما يخص الثانية متوسط من مذكرات ووثائق للأساتذة
» المنهاج والوثيقة المرافقة له للجيل الثاني في كل المواد لمرحلة التعليم المتوسط
» دليل استخدام كتاب الرياضيات الجيل الثاني سنة4